
�}Ŀ�б�(�����𰸺ͽ���)
| ||
| a |
| 32 |
| V |
| 22.4 |
| a |
| 32 |
| V |
| 22.4 |
| �� |
| �� |
| �� |
| O | 2- 4 |
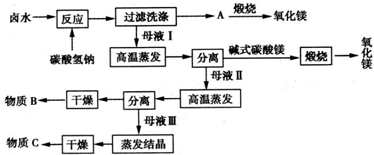
| �ض�/�� | 30 | 40 | 50 | 60 | 70 |
| MgO���|(zh��)����?j��n)?sh��)/% | 97.75 | 97.56 | 97.86 | 99.13 | 99.01 |
| ||
| ||
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com