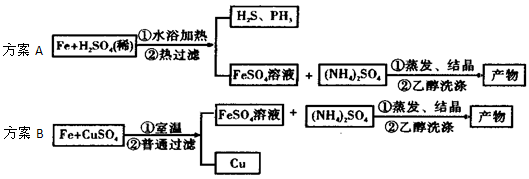
硫酸亞鐵銨[(NH4)2SO4·FeSO4·6H2O]又稱摩爾鹽�����。某興趣小組制備硫酸亞鐵銨的實(shí)驗方案示意圖如下:
已知:H2S����、PH3為有毒氣體,都能被CuSO4溶液吸收除去���。請回答下列問題:
(1)實(shí)驗前都需將廢鐵屑放入碳酸鈉溶液中煮沸�����,傾倒出液體�����,用水洗凈鐵屑�����。從以下儀器中選擇組裝���,完成該操作必需的儀器有________ (填編號)�。
①鐵架臺 ②玻璃棒 ③廣口瓶 ④石棉網(wǎng) ⑤燒杯 ⑥漏斗 ⑦酒精燈
(2)方案A中FeSO4溶液的制備:將處理好的鐵屑放入錐形瓶���,加入過量的3 mol/LH2SO4溶液�����,加熱至充分反應(yīng)為止��。趁熱過濾���,收集濾液和洗滌液。下右圖裝置中方框內(nèi)選擇更適合用于實(shí)驗方案A的裝置是__________ (填“甲”或“乙”)�。
(3)方案A中廢鐵屑中含氧化鐵,無需在制備前除去����,理由是__________________(用離子方程式回答),用無水乙醇洗滌晶體的原因是___________________。
(4)實(shí)驗方案B中FeSO4溶液的制備:用“五水硫酸銅結(jié)晶水的測定”實(shí)驗中的廢棄物--無水硫酸銅粉末代替稀硫酸與鐵屑反應(yīng)制備硫酸亞鐵�。當(dāng)用無水硫酸銅配制的溶液由藍(lán)色完全變?yōu)闇\綠色時停止反應(yīng),過濾���,收集濾液即得硫酸亞鐵溶液。此方案的優(yōu)點(diǎn)有_________ (填編號)����。
a. 充分利用了實(shí)驗室廢棄物--硫酸銅粉末,避免了藥品浪費(fèi)�,又回收了金屬銅,實(shí)現(xiàn)了變廢為寶
b. 避免了有毒氣體的排放對環(huán)境造成的污染
c. 原子利用率達(dá)到100%
d. 避免了在加熱中Fe2+被氧化成Fe3+��, 有利于產(chǎn)品質(zhì)量等級的提高�����,并節(jié)約了能源
(5)產(chǎn)品中Fe3+雜質(zhì)的定量分析
①配制Fe3+濃度為1.0mg/mL的標(biāo)準(zhǔn)溶液100mL��。稱取_________mg高純度的硫酸鐵銨(NH4)Fe(SO4)2·12H2O�����,加 2.00 mL經(jīng)處理的去離子水��,振蕩溶解后,加入2mol/L HBr 溶液 l m L和 l mol/L KSCN溶液0.5 mL�����,加水制成100 mL溶液�����。配制過程中必須用到的定量儀器為________(選填編號)����。
a. 精確度為0.001g的電子天平
b.精確度為0.1mg的電子天平
c.100 mL容量瓶
d.酸式滴定管
e.10mL量筒
②將上述溶液稀釋為濃度分別為0.2、1.0�����、3.0�����、5.0���、7.0��、10.0(單位:mg/L)的溶液��。分別測定不同濃度溶液對光的吸收程度�����,并將測定結(jié)果繪制成曲線如下����。
③取該興趣小組所得的硫酸亞鐵銨產(chǎn)品,按步驟①配得產(chǎn)品溶液10mL����,稀釋至100 mL����,然后按步驟②的方法進(jìn)行測定,兩次測定所得的吸光度分別為0.490���、0.510���,則該興趣小組所配產(chǎn)品硫酸亞鐵銨溶液中所含F(xiàn)e3+濃度為_________mg/L。