
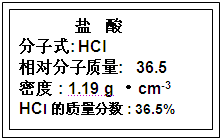
�}Ŀ�б�(�����𰸺ͽ���)

 [���W--���|�Y���c���|]
[���W--���|�Y���c���|]| ���W�I | C-O | C�TO | C��O |
| �I�ܣ�kJ/mol�� | 351 | 803 | 1071 |
| ���W�� | N-N | N�TN | N��N |
| �I�ܣ�kj/mol�� | 159 | 418 | 945 |
Fe3+��I-��ˮ��Һ�еķ������£�2I-+2Fe3+�T2Fe2++I2��ˮ��Һ�����������ʺ�I-��Fe3+�ĝ���Pϵ��v=k[I-]m[Fe3+]n��k�鳣����
|
����ʡ��(li��n)�W�`���Ͳ�����Ϣ�e��ƽ�_ | �W���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙��e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com