
Ó}ƒø¡–±Ì(∞¸¿®¥∞∏∫ÕΩ‚Œˆ)
| 1 |
| 2 |
2- 4 |
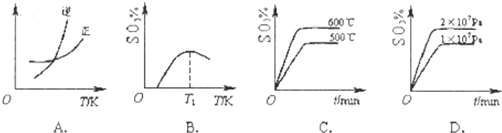
 œÚ“ªÇÄ»ð∑eûÈ2Lµƒ∫„úÿ»ð√ÐÈ]»ð∆˜÷–Õ®»Î2molA£¨∞l(f®°)…˙»Áœ¬∑¥ë™£∫
œÚ“ªÇÄ»ð∑eûÈ2Lµƒ∫„úÿ»ð√ÐÈ]»ð∆˜÷–Õ®»Î2molA£¨∞l(f®°)…˙»Áœ¬∑¥ë™£∫| 1 | 2 |


| ||
| (“ª∂®ólº˛) |

∞Ÿ∂»÷¬–≈ - æö¡ïÉ‘¡–±Ì - ‘áÓ}¡–±Ì
∫˛±± °ª•¬ì(li®¢n)æWþ`∑®∫Õ≤ª¡º–≈œ¢≈eàÛ∆Ω≈_ | æW…œ”–∫¶–≈œ¢≈eàÛå£Ö^(q®±) | Îä–≈‘pÚ_≈eàÛå£Ö^(q®±) | …Êöv ∑Ãìüo÷˜¡x”–∫¶–≈œ¢≈eàÛå£Ö^(q®±) | …Ê∆Û«÷ôý≈eàÛå£Ö^(q®±)
þ`∑®∫Õ≤ª¡º–≈œ¢≈eàÛÎä‘í£∫027-86699610 ≈eàÛý]œ‰£∫58377363@163.com